Los átomos son la parte mas pequeña de la materia. Son tan pequeños que
una gota de agua contiene millones de átomos. El conocimiento del
tamaño y la naturaleza avanzó lentamente a lo largo de los años. Los
químicos se dieron cuenta de que todos los líquidos, gases, sólidos
pueden descomponerse en sus últimos constituyentes o elementos. El
enlace químico es una unión de elementos.
CARACTERÍSTICAS DE LOS ÁTOMOS:
 Bueno
amigos, como sabéis hemos empezado con química, y ya hemos visto las
primeras ideas y experiencias sobre los átomos. Ahora vamos a ver sus
características...
Bueno
amigos, como sabéis hemos empezado con química, y ya hemos visto las
primeras ideas y experiencias sobre los átomos. Ahora vamos a ver sus
características...Un átomo está compuesto por una corteza y un núcleo. En la corteza se sitúan los electrones y en el núcleo se encuentran los protones y neutrones.
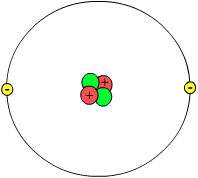
Que un átomo sea neutro quiere decir que el número de protones (p+) y el de electrones (e-) es el mismo. Lo cual, la fórmula de un átomo neutro es < nº p + = nº e- >
Lo que caracteriza a cada elemento es el número de protones ( nº p+ ), es decir, su nº atómico.
El número atómico ( Z ) es el número de protones que tiene un átomo.
El número másico ( A ) es la suma de los p+ ( protones ) y neutrones. Lo cual < A = Z + N > Siendo N el número de neutrones.

¿ Cómo se representa el núcleo atómico ?
· Símbolo del elemento en el centro
· Nº másico en la esquina superior izq.
· Nº atómico en la esquina inferior izq.
IMPORTANCIA:
El primero en utilizar este término fue Demócrito, porque creía que todos los elementos deberían estar formados por pequeñas partículas que fueran INDIVISIBLES. Átomo, en griego, significa INDIVISIBLE.
Hoy día sabemos, que los átomos no son, como creía Demócrito, indivisibles.
De hecho están formados por partículas.
Estas partículas son:
ELECTRÓN Es una partícula elemental con carga eléctrica negativa igual a 1,602 x 10-19 coulomb y masa igual a 9,1083 x 10-28 g, que se encuentra formando parte de los átomos de todos los elementos.
NEUTRÓN Es una partícula elemental eléctricamente neutra y masa ligeramente superior a la del protón, que se encuentra formando parte de los átomos de todos los elementos.
PROTÓN Es una partícula elemental con carga eléctrica positiva igual a 1,602 x 10-19 coulomb y cuya masa es 1837 veces mayor que la del electrón , que se encuentra formando parte de los átomos de todos los elementos.
MODELOS ATÓMICOS
Modelo atómica de Dalton
En 1808,
John
Dalton publicó su teoría atómica, que retomaba las antiguas ideas
de Leucipo y de Demócrito. Según la teoría de Dalton:
1.- Los elementos
están formados por partículas diminutas, indivisibles e inalterables
llamadas átomos.
Dalton estableció un
sistema para designar a cada átomo de forma que se pudieran distinguir entre
los distintos elementos:
2.- Los átomos de un
mismo elemento son todos iguales entre sí en masa, tamaño y en el resto de
las propiedades físicas o químicas. Por el contrario, los átomos de
elementos diferentes tienen distinta masa y propiedades.
3.- Los compuestos se
forman por la unión de átomos de los correspondientes elementos según una
relación numérica sencilla y constante.
De la teoría atómica
de Dalton se pueden obtener las siguientes definiciones:
- Un átomo es
la partícula más pequeña de un elemento que conserva sus propiedades.
- Un elemento
es una sustancia pura que está formada por átomos iguales.
- Un compuesto
es una sustancia que está formada por átomos distintos combinados en una
relación numérica sencilla y constante.
Modelo atómico de Thomson
Por ser tan pequeña la masa de los
electrones, el físico inglés
J. J. Thomson supuso, en 1904, que la mayor parte de la masa del átomo
correspondía a la carga positiva, que, por tanto, debía ocupar la mayor
parte del volumen atómico. Thomson imaginó el átomo como una especie de
esfera positiva continua en la que se encuentran incrustados los electrones
(como las pasas en un pudin).
 |
|
|
Este modelo permitía explicar varios
fenómenos experimentales como la electrización y la formación de iones.
- La electrización: Es el exceso
o la deficiencia de electrones que tiene un cuerpo y es la responsable de su
carga eléctrica negativa o positiva.
- La formación de iones: Un ion
es un átomo que ha ganado o ha perdido electrones. Si gana electrones tiene
carga neta negativa y se llama anión y si pierde electrones tiene
carga neta positiva y se llama catión.
Modelo atómico de Rutherford
El modelo de Thomson tuvo una gran
aceptación hasta que, en 1911, el químico y físico inglés
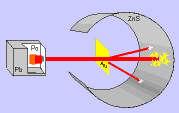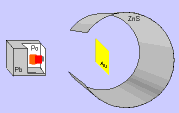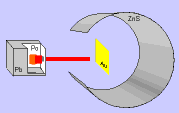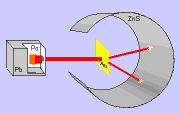
Ernest Rutherford y sus colaboradores llevaron a cabo el "Experimento de
Rutherford".
En esta
página puedes ver cómo este experimento ofrecía unos resultados que no
podían explicarse con el modelo de átomo que había propuesto Thomson y, por
tanto, había que cambiar el modelo.
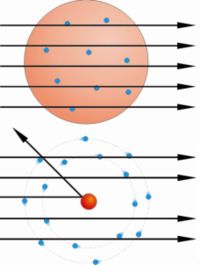
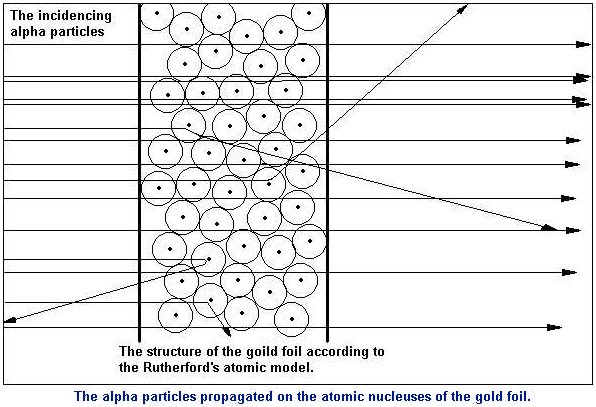
En el experimento se bombardeaba una
fina lámina de oro con partículas alfa (positivas) procedentes de un
material radiactivo y se observaba que:
- La mayor parte de las partículas alfa
atravesaban la lámina sin cambiar de dirección, como era de esperar.
- Algunas partículas alfa se
desviaron considerablemente.
- Unas pocas partículas alfa
rebotaron hacia la fuente de emisión.
Puedes ver el experimento en este
vídeo.
Aquí tienes otra versión interactiva del mismo experimento.
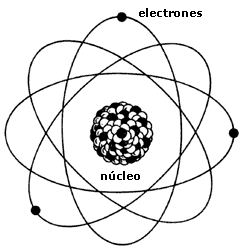
El Modelo atómico de Rutherford o
modelo nuclear establece que:
- El átomo tiene un núcleo central en el
que están concentradas la carga positiva y casi toda la masa.
- La carga positiva de los protones del
núcleo se encuentra compensada por la carga negativa de los electrones, que
están fuera del núcleo.
- El núcleo contiene, por tanto,
protones en un número igual al de electrones del átomo.
- Los electrones giran a mucha velocidad
alrededor del núcleo y están separados de éste por una gran distancia.
Los neutrones
La masa de protones y electrones no
coincidía con la masa total del átomo; por tanto, Rutherford supuso que
tenía que haber otro tipo de partículas subatómicas en el núcleo de los
átomos.
Estas partículas fueron descubiertas en
1933 por J. Chadwick. Al no tener carga eléctrica recibieron el nombre de
neutrones.
Los neutrones son partículas sin carga y
de masa algo mayor que la masa de un protón.
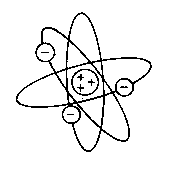
Estructura del átomo
Según esto, el átomo quedó constituido
así:
- Una zona central o NÚCLEO donde
se encuentra la carga total positiva (la de los protones) y la mayor parte
de la masa del átomo, aportada por los protones y los neutrones.
- Una zona externa o CORTEZA
donde se hallan los electrones, que giran alrededor del núcleo.
Hay los mismos electrones en la corteza
que protones en el núcleo, por lo que el conjunto del átomo es
eléctricamente neutro.
 |
 |
No hay comentarios:
Publicar un comentario